En este artículo hemos realizado un trabajo sobre el descubridor del núcleo atomico: Ernest Rutherford.
1. J.J thomsom en 1884 se convirtió en profesor de Física Cavendish. Uno de sus alumnos fue Ernest Rutherford, quién más tarde sería su sucesor en el puesto. Rutherford siguió los pasos de su profesor J.J thomsom y realizo investigaciones para descubrir la estructura de átomo pero eso lo explicaremos después.En 1907 Geiger empezó a trabajar junto a Ernest Rutherford en la Universidad de Manchester. Geiger invento el contador Geiger que es un instrumento que permite medir la radiactividad. Si nos damos cuenta, (ya lo veremos mas adelante) Rutherford hizo estudios sobre este tema. Si una persona como thomsom te enseña sus investigaciones y sus proezas estamos seguros de que serás un gran científico y llegaras donde quieras porque has tenido un gran profesor. Así ha pasado con estos 3 grandes científicos que han llegado a conseguir un premio Nobel.
1. J.J thomsom en 1884 se convirtió en profesor de Física Cavendish. Uno de sus alumnos fue Ernest Rutherford, quién más tarde sería su sucesor en el puesto. Rutherford siguió los pasos de su profesor J.J thomsom y realizo investigaciones para descubrir la estructura de átomo pero eso lo explicaremos después.En 1907 Geiger empezó a trabajar junto a Ernest Rutherford en la Universidad de Manchester. Geiger invento el contador Geiger que es un instrumento que permite medir la radiactividad. Si nos damos cuenta, (ya lo veremos mas adelante) Rutherford hizo estudios sobre este tema. Si una persona como thomsom te enseña sus investigaciones y sus proezas estamos seguros de que serás un gran científico y llegaras donde quieras porque has tenido un gran profesor. Así ha pasado con estos 3 grandes científicos que han llegado a conseguir un premio Nobel.
2. ¿Cuales son las principales diferencias entre física y química?
 Para empezar sería conveniente explicar primero que es la física y qué es la química, estas dos ciencias se diferencian entre ellas pero es una diferencia que a la gente le cuesta mucho esplicar. La física es la ciencia que estudia las propiedades de los cuerpos y los diferentes factores que actúan sobre ellos sin que cambie su naturaleza. La química es la ciencia que estudia la composición y estructura de la materia hasta el nivel atómico, y especialmente las transformaciones que ésta puede sufrir madiante diversos procesos que cambian su composición. Tras haber definido y entendido bien estas dos ciencias, podemos sacar que la principal diferencia entre una y otra es que en la física, se estudian los cuerpos sometiéndolos a diferentes situaciones en las que las propiedades del elemento estudiado no varían, mientras que en la química se estudian los cuerpos o elementos sometidos a situaciones que si que afectan a sus propiedades. Una frase de Rutherford fue: ''Toda ciencia, o es física, o es coleccionismo de sellos''. Esta frase lo que quiere decir es que para él la física es lo más impotante, lo más necesario, que todo lo demás es prescindible, es decir, que es como un hobby. Otra, ya después de haberle entregado el premio nobel de química fue: ''He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfósis de físico a químico''. Aquí Rutherford se sentiría un poco sorprendido después de haber recibido este premio y no el de física (ya que como hemos dicho antes, él era físico, y no había ninguna otra ciencia más importante). Este premio se le fue entregado gracias a sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas, junto a su ayudante Hans Geiger. Suponemos que al citar esta frase, Rutherford había aceptado que la química también es importante para la evolución de la especie humana y que en cierta manera, estas dos ciencias, la física y la química, al fin y al cabo no son tan diferentes.
Para empezar sería conveniente explicar primero que es la física y qué es la química, estas dos ciencias se diferencian entre ellas pero es una diferencia que a la gente le cuesta mucho esplicar. La física es la ciencia que estudia las propiedades de los cuerpos y los diferentes factores que actúan sobre ellos sin que cambie su naturaleza. La química es la ciencia que estudia la composición y estructura de la materia hasta el nivel atómico, y especialmente las transformaciones que ésta puede sufrir madiante diversos procesos que cambian su composición. Tras haber definido y entendido bien estas dos ciencias, podemos sacar que la principal diferencia entre una y otra es que en la física, se estudian los cuerpos sometiéndolos a diferentes situaciones en las que las propiedades del elemento estudiado no varían, mientras que en la química se estudian los cuerpos o elementos sometidos a situaciones que si que afectan a sus propiedades. Una frase de Rutherford fue: ''Toda ciencia, o es física, o es coleccionismo de sellos''. Esta frase lo que quiere decir es que para él la física es lo más impotante, lo más necesario, que todo lo demás es prescindible, es decir, que es como un hobby. Otra, ya después de haberle entregado el premio nobel de química fue: ''He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfósis de físico a químico''. Aquí Rutherford se sentiría un poco sorprendido después de haber recibido este premio y no el de física (ya que como hemos dicho antes, él era físico, y no había ninguna otra ciencia más importante). Este premio se le fue entregado gracias a sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas, junto a su ayudante Hans Geiger. Suponemos que al citar esta frase, Rutherford había aceptado que la química también es importante para la evolución de la especie humana y que en cierta manera, estas dos ciencias, la física y la química, al fin y al cabo no son tan diferentes.
3. Vamos a hablar sobre diferentes aportaciones de Nikola Tesla y de los descubrimientos más importantes en este siglo. Físico croata, Nikola Tesla nació el 10 julio de 1856 en la ciudad croata de Smiljan. Fue físico, matemático, ingeniero eléctrico e inventor. Falleció en Nueva York el 7 de enero de 1943, en plena guerra mundial. Nació en una época caracterizada por las continuas revoluciones sociales que habían sido iniciadas en el periodo de la ilustración con la revolución francesa pero cuyo auge fue el siglo XIX durante los periodos del romanticismo y el realismo. Estudió en Graz pero fue en Praga donde estudió ingeniería eléctrica. Realizo numerosos viajes por europa y en París trabajó en una de las compañías de Edison donde realizó su mayor aportación: la teoría de la corriente alterna en electricidad, lo que le permitió idear el primer motor de inducción en 1882. Durante años postreros se traslada a Nueva York donde crea su propia empresa pues se había enfadao con Edison. Tenía un laboratorio y en 1887 construyó el motor de inducción de corriente alterna y trabajando en el laboratorio Westinghouse concibe el primer sistema polifásico para trasladar la electricidad a largas distancias. Consiguió transmitir energía electromagnética sin cables, construyendo el primer radiotransmisor. Realizó una exhibición pública de la corriente alterna, demostrando su superioridad sobre la corriente continua de Edison. Patentó el invento dos años después de que Marconi lograra su primera transmisión de radio. Aun así Marconi va a registrarlo y se encuentra con que Tesla ya lo había hecho con lo que es rechazada por ser una copia de la de Tesla. Se inició así una "pelea" entre las industrias de Marconi y de Tesla. Finalmente un conjunto de científicos destacados y la Suprema Corte de EEUU dan la razón a Tesla, equivocadamente y de hecho hoy en día en muchos libros aparece Marconi como inventor de la radio. Más tarde demostró que usando una red eléctrica resonante y utilizando una corriente alterna de alta frecuencia, aunque hoy día se considera de baja, solo se necesitaba un único conductor para alimentar un sistema eléctrico (solo hay que ver que para enchufar la batidora solo necesitamos un cable), sin necesidad de otro metal ni un conductor de tierra. A esto lo llamo textualmente: "transmisión de energía eléctrica a través de un único cable sin retorno". Tesla afirmó en 1901: "Hace unos diez años, reconocí el hecho de que para transportar corrientes eléctricas a largas distancias no era en léctrica a través de un único cable sin retorno". Hizo demostraciones de éste instrumento. Se le considera el inv entor de la industria eléctrica y se inventó la bobina que lleva su nombre. Además a la unidad de campo magnético en el SI se la llamó Tesla en su honor. Si resumimos sus principales aportaciones al mundo de la ciencia fueron (siempre aportaciones en el campo del magnetismo y la electricidad):
entor de la industria eléctrica y se inventó la bobina que lleva su nombre. Además a la unidad de campo magnético en el SI se la llamó Tesla en su honor. Si resumimos sus principales aportaciones al mundo de la ciencia fueron (siempre aportaciones en el campo del magnetismo y la electricidad):
- construyó el primer radiotransmisor de tecnología inalámbrica (radio).

- descubrió la corriente alterna utilizando el motor asíncrono inventado también por él.he aqui un video de un generador de corriente alterna.
- inventó el motor asíncrono. Un motor de inducción de corriente alterna.
- descubre el campo magnetico rotativo. Es lo de que solo se necesita un conductor para alimentar un sistema eléctrico.
Como el lector habrá comprobado en la biografía, Tesla no se llevaba bien con dos físicos, Marconi y Edison con el que tuvo algunas disputas de carácter científico.
Edison: con Edison mantuvo una disputa que la podemos apodar guerra de las corrientes. A finales del siglo XIX hubo una guerra comercial entre las compañías eléctricas de Edison y las de Tesla. Lo que ocurrió es que el sistema de Edison utilizaba corriente contínua mientras que el de Tesla se basaba en la corriente alterna y con la solución contínua se estaba obligado a distribuir usinas generadoras cada pocos metros dentro de las ciudades mientras que con la alterna se podía generar a grandes distancias como lo demostraba el alimentar la ciudad de Buffalo con la central hidroeléctrica de las catarátas del Niágara a 32 km de distancia. Finalmente está claro que ganó Tesla pues su sistema era más cómodo y barato. Hoy día la alterna es la utilizada universalmente.He aqui un video de el funcionamiento de un motor a corriente continua. Vemos que la corriente pasa por un extremo y sale por el otro mientras que en uno de corriente alterna la corriente fluye distintamente. Unicamente necesitamos un alimentador.
Marconi: con Marconi tuvo un enfrentamiento que consideramos más grave que el otro y que el consejo de gente que decidió en favor de Tesla se equivocó totalmente. Marconi fue el primero en realizar una transmisión de un mensaje oral de forma inalámbrica pero no lo patentó. A los dos años Tesla consiguió hacer una y si la patentó. Marconi la fue a registrar meses después y se la dieron como copia de la de Tesla. Ambos tuvieron una disputa y finalmente un consejo se lo dio a Tesla muy injustamente porque creemos que para un científico no hay cosa peor que te roben un descubrimiento. Esto provocó un enfrentamiento entre ambas industrias. El experimento no le fue reconocido a Marconi hasta después de su muerte y en muchos libros aparece el como inventor de la radio, de hecho, nosotros en primero de la eso hicimos un trabajo de los físicos y el grupo que hizo Marconi habló de la radio como inventó suyo aunque nombró también a Tesla pero no como inventor.
linea del tiempo. Ver con un aumento a 100 años.
4. En este punto responderemos a algunas cuestiones planteadas, basandonos en el libro de lectura ''De Arquímedes a Einstein''.
 b) Los Rayos X: Son unos rayos con la capacidad de penetrar en ciertas sustancias como la piel, tejidos, hojas de aluminio, etc. que fueron utilizados (y siguen siéndolo) especialmente para la medicina, para tratar los temas de fisuras...
b) Los Rayos X: Son unos rayos con la capacidad de penetrar en ciertas sustancias como la piel, tejidos, hojas de aluminio, etc. que fueron utilizados (y siguen siéndolo) especialmente para la medicina, para tratar los temas de fisuras...
Con los rayos X se obtenían unas imágenes del elemento sometido a estos mismos, nítidos, como si no se nos interpusiese nada, como si la piel no tubiese color (en caso de que el elemento sometido a la radiación de rayos X fuese un tejido).
e) Alfa, gamma y beta: Alfa, gamma y beta son distintos tipos de radiaciones, son los tres tipos de de emisiones en las que se descompone la radiactividad. Las primeras en ser descubiertas fueron alfa y beta, descubiertas por Rutherford. Éste se dió cuenta de que los elementos radiactivos emitían dos tipos de rayos a los que denominó por los nombres anteriormente citados, alfa y beta. Después ya en la universidad de Canadá se dió cuenta de que no se emitían dos tipos de rayos, si no tres: alfa, gamma y beta.
La radiación gamma es la más energética de la tres, es una radiación que tiene una altísima frecuencia, pero como consecuencia, una cortísima longitud de onda. Después, en orden de mayor a menor, se sitúa la radiación beta, que es un flujo de electrones, y en último lugar, como radiación menos energética, se situaría la radiación alfa, que eran átomos de helio doblemente ionizados (H++) (esté tipo de rayos fue el que utilizó Rutherford para llevar a cabo quizá su experimento más conocido, el de bombardear una lamina de oro con partículas alfa, experimento tras el cúal consigió deducir que en un átomo, los electrones se encontraban en una capa separada del núcleo, y no dentro del mismo como dijo Thomson). Estas partículas tambien se podían obtener colocando una fuente radiactiva intensa en un contenedor de plomo con una pequeña abertura.
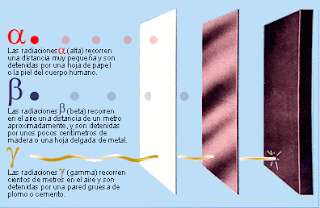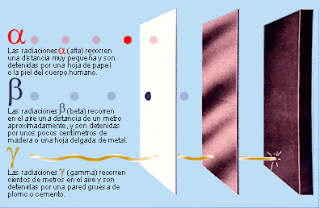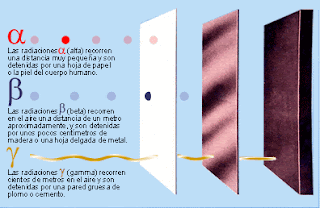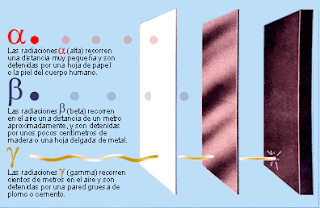 En esta otra foto se puede observar con gran facilidad el nivel de energía que posee cada una.
En esta otra foto se puede observar con gran facilidad el nivel de energía que posee cada una.
 Para empezar sería conveniente explicar primero que es la física y qué es la química, estas dos ciencias se diferencian entre ellas pero es una diferencia que a la gente le cuesta mucho esplicar. La física es la ciencia que estudia las propiedades de los cuerpos y los diferentes factores que actúan sobre ellos sin que cambie su naturaleza. La química es la ciencia que estudia la composición y estructura de la materia hasta el nivel atómico, y especialmente las transformaciones que ésta puede sufrir madiante diversos procesos que cambian su composición. Tras haber definido y entendido bien estas dos ciencias, podemos sacar que la principal diferencia entre una y otra es que en la física, se estudian los cuerpos sometiéndolos a diferentes situaciones en las que las propiedades del elemento estudiado no varían, mientras que en la química se estudian los cuerpos o elementos sometidos a situaciones que si que afectan a sus propiedades. Una frase de Rutherford fue: ''Toda ciencia, o es física, o es coleccionismo de sellos''. Esta frase lo que quiere decir es que para él la física es lo más impotante, lo más necesario, que todo lo demás es prescindible, es decir, que es como un hobby. Otra, ya después de haberle entregado el premio nobel de química fue: ''He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfósis de físico a químico''. Aquí Rutherford se sentiría un poco sorprendido después de haber recibido este premio y no el de física (ya que como hemos dicho antes, él era físico, y no había ninguna otra ciencia más importante). Este premio se le fue entregado gracias a sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas, junto a su ayudante Hans Geiger. Suponemos que al citar esta frase, Rutherford había aceptado que la química también es importante para la evolución de la especie humana y que en cierta manera, estas dos ciencias, la física y la química, al fin y al cabo no son tan diferentes.
Para empezar sería conveniente explicar primero que es la física y qué es la química, estas dos ciencias se diferencian entre ellas pero es una diferencia que a la gente le cuesta mucho esplicar. La física es la ciencia que estudia las propiedades de los cuerpos y los diferentes factores que actúan sobre ellos sin que cambie su naturaleza. La química es la ciencia que estudia la composición y estructura de la materia hasta el nivel atómico, y especialmente las transformaciones que ésta puede sufrir madiante diversos procesos que cambian su composición. Tras haber definido y entendido bien estas dos ciencias, podemos sacar que la principal diferencia entre una y otra es que en la física, se estudian los cuerpos sometiéndolos a diferentes situaciones en las que las propiedades del elemento estudiado no varían, mientras que en la química se estudian los cuerpos o elementos sometidos a situaciones que si que afectan a sus propiedades. Una frase de Rutherford fue: ''Toda ciencia, o es física, o es coleccionismo de sellos''. Esta frase lo que quiere decir es que para él la física es lo más impotante, lo más necesario, que todo lo demás es prescindible, es decir, que es como un hobby. Otra, ya después de haberle entregado el premio nobel de química fue: ''He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfósis de físico a químico''. Aquí Rutherford se sentiría un poco sorprendido después de haber recibido este premio y no el de física (ya que como hemos dicho antes, él era físico, y no había ninguna otra ciencia más importante). Este premio se le fue entregado gracias a sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas, junto a su ayudante Hans Geiger. Suponemos que al citar esta frase, Rutherford había aceptado que la química también es importante para la evolución de la especie humana y que en cierta manera, estas dos ciencias, la física y la química, al fin y al cabo no son tan diferentes.3. Vamos a hablar sobre diferentes aportaciones de Nikola Tesla y de los descubrimientos más importantes en este siglo. Físico croata, Nikola Tesla nació el 10 julio de 1856 en la ciudad croata de Smiljan. Fue físico, matemático, ingeniero eléctrico e inventor. Falleció en Nueva York el 7 de enero de 1943, en plena guerra mundial. Nació en una época caracterizada por las continuas revoluciones sociales que habían sido iniciadas en el periodo de la ilustración con la revolución francesa pero cuyo auge fue el siglo XIX durante los periodos del romanticismo y el realismo. Estudió en Graz pero fue en Praga donde estudió ingeniería eléctrica. Realizo numerosos viajes por europa y en París trabajó en una de las compañías de Edison donde realizó su mayor aportación: la teoría de la corriente alterna en electricidad, lo que le permitió idear el primer motor de inducción en 1882. Durante años postreros se traslada a Nueva York donde crea su propia empresa pues se había enfadao con Edison. Tenía un laboratorio y en 1887 construyó el motor de inducción de corriente alterna y trabajando en el laboratorio Westinghouse concibe el primer sistema polifásico para trasladar la electricidad a largas distancias. Consiguió transmitir energía electromagnética sin cables, construyendo el primer radiotransmisor. Realizó una exhibición pública de la corriente alterna, demostrando su superioridad sobre la corriente continua de Edison. Patentó el invento dos años después de que Marconi lograra su primera transmisión de radio. Aun así Marconi va a registrarlo y se encuentra con que Tesla ya lo había hecho con lo que es rechazada por ser una copia de la de Tesla. Se inició así una "pelea" entre las industrias de Marconi y de Tesla. Finalmente un conjunto de científicos destacados y la Suprema Corte de EEUU dan la razón a Tesla, equivocadamente y de hecho hoy en día en muchos libros aparece Marconi como inventor de la radio. Más tarde demostró que usando una red eléctrica resonante y utilizando una corriente alterna de alta frecuencia, aunque hoy día se considera de baja, solo se necesitaba un único conductor para alimentar un sistema eléctrico (solo hay que ver que para enchufar la batidora solo necesitamos un cable), sin necesidad de otro metal ni un conductor de tierra. A esto lo llamo textualmente: "transmisión de energía eléctrica a través de un único cable sin retorno". Tesla afirmó en 1901: "Hace unos diez años, reconocí el hecho de que para transportar corrientes eléctricas a largas distancias no era en léctrica a través de un único cable sin retorno". Hizo demostraciones de éste instrumento. Se le considera el inv
 entor de la industria eléctrica y se inventó la bobina que lleva su nombre. Además a la unidad de campo magnético en el SI se la llamó Tesla en su honor. Si resumimos sus principales aportaciones al mundo de la ciencia fueron (siempre aportaciones en el campo del magnetismo y la electricidad):
entor de la industria eléctrica y se inventó la bobina que lleva su nombre. Además a la unidad de campo magnético en el SI se la llamó Tesla en su honor. Si resumimos sus principales aportaciones al mundo de la ciencia fueron (siempre aportaciones en el campo del magnetismo y la electricidad): - construyó el primer radiotransmisor de tecnología inalámbrica (radio).


- descubrió la corriente alterna utilizando el motor asíncrono inventado también por él.he aqui un video de un generador de corriente alterna.
- inventó el motor asíncrono. Un motor de inducción de corriente alterna.
- descubre el campo magnetico rotativo. Es lo de que solo se necesita un conductor para alimentar un sistema eléctrico.
Como el lector habrá comprobado en la biografía, Tesla no se llevaba bien con dos físicos, Marconi y Edison con el que tuvo algunas disputas de carácter científico.
Edison: con Edison mantuvo una disputa que la podemos apodar guerra de las corrientes. A finales del siglo XIX hubo una guerra comercial entre las compañías eléctricas de Edison y las de Tesla. Lo que ocurrió es que el sistema de Edison utilizaba corriente contínua mientras que el de Tesla se basaba en la corriente alterna y con la solución contínua se estaba obligado a distribuir usinas generadoras cada pocos metros dentro de las ciudades mientras que con la alterna se podía generar a grandes distancias como lo demostraba el alimentar la ciudad de Buffalo con la central hidroeléctrica de las catarátas del Niágara a 32 km de distancia. Finalmente está claro que ganó Tesla pues su sistema era más cómodo y barato. Hoy día la alterna es la utilizada universalmente.He aqui un video de el funcionamiento de un motor a corriente continua. Vemos que la corriente pasa por un extremo y sale por el otro mientras que en uno de corriente alterna la corriente fluye distintamente. Unicamente necesitamos un alimentador.
Marconi: con Marconi tuvo un enfrentamiento que consideramos más grave que el otro y que el consejo de gente que decidió en favor de Tesla se equivocó totalmente. Marconi fue el primero en realizar una transmisión de un mensaje oral de forma inalámbrica pero no lo patentó. A los dos años Tesla consiguió hacer una y si la patentó. Marconi la fue a registrar meses después y se la dieron como copia de la de Tesla. Ambos tuvieron una disputa y finalmente un consejo se lo dio a Tesla muy injustamente porque creemos que para un científico no hay cosa peor que te roben un descubrimiento. Esto provocó un enfrentamiento entre ambas industrias. El experimento no le fue reconocido a Marconi hasta después de su muerte y en muchos libros aparece el como inventor de la radio, de hecho, nosotros en primero de la eso hicimos un trabajo de los físicos y el grupo que hizo Marconi habló de la radio como inventó suyo aunque nombró también a Tesla pero no como inventor.
linea del tiempo. Ver con un aumento a 100 años.
4. En este punto responderemos a algunas cuestiones planteadas, basandonos en el libro de lectura ''De Arquímedes a Einstein''.
a) Diferencia entre fluorescencia y fosforescencia: La fluorescencia y la fosforecencia son dos tipos de luminiscencias y se pueden dividir en dos clases de minerales: los minerales fluorescentes y los minerales fosforescentes. Las diferencias entre ambos son que los elementos fluorescentes emiten una luz azulada al ser estimulados por una radiación externa, mientras que los elementos fosforescentes, la luz que emiten, tiene un color verdoso, y ésta continúa a pesar de que ya no se esté iluminando a dicho elemento, esta iluminación tiene que provenr de una luz normal. Tambien un factor del que dependen estos dos fenómenos es la cantidad de flúor (en los elementos fluorescentes) y fósforo (en los elementos fosforescentes).
(Emos elegido este video puesto que en él se diferencian claramente estos dos procesos de los que hemos hablado y se entienden bien con él las diferencias entre un proceso y otro) b) Los Rayos X: Son unos rayos con la capacidad de penetrar en ciertas sustancias como la piel, tejidos, hojas de aluminio, etc. que fueron utilizados (y siguen siéndolo) especialmente para la medicina, para tratar los temas de fisuras...
b) Los Rayos X: Son unos rayos con la capacidad de penetrar en ciertas sustancias como la piel, tejidos, hojas de aluminio, etc. que fueron utilizados (y siguen siéndolo) especialmente para la medicina, para tratar los temas de fisuras...Con los rayos X se obtenían unas imágenes del elemento sometido a estos mismos, nítidos, como si no se nos interpusiese nada, como si la piel no tubiese color (en caso de que el elemento sometido a la radiación de rayos X fuese un tejido).
c) La radiactividad: La radiactividad es la emisión de radiaciones u ondas electromagnéticas emitidas desde los núcleos de algunas sustancias sin necesidad de haber sido expuestas a la luz. Es la desintegración espontánea de ciertos átomos pesados.
Fue descubierta por Becquerel con un poco de suerte, y definido de forma más científica por el matrimonio de Marie Curie. Se habla de suerte, puesto que Becquerel quería exponer al Sol una placa fotográfica cubierta con papel negro, sobre el que ponía una moneda. Todo ésto luego lo recubría con sal de uranio. Como estabamos diciendo, lo quería exponer a la luza solar, puesto que tenía que dar una charla en la Academia y quería enseñarles a los oyentes los efectos de la fosforescencia, pero los últimos dias habian estado muy nublados, por lo que no pudo exponer su placa fotográfica al Sol, cuando fué a mirar tan solo para mostrar los efectos de la fosforescencia débil, se dió cuenta de que la moneda salía tan nítida como si hubiese sido expuesta a la luz solar. De esta manera descubrió Becquerel la radiactividad sin tener constancia de la impotancia de su descubrimiento hasta la definición del mismo por parte del matrimonio Curie, como hemos dicho antes.
oyentes los efectos de la fosforescencia, pero los últimos dias habian estado muy nublados, por lo que no pudo exponer su placa fotográfica al Sol, cuando fué a mirar tan solo para mostrar los efectos de la fosforescencia débil, se dió cuenta de que la moneda salía tan nítida como si hubiese sido expuesta a la luz solar. De esta manera descubrió Becquerel la radiactividad sin tener constancia de la impotancia de su descubrimiento hasta la definición del mismo por parte del matrimonio Curie, como hemos dicho antes.
(Esta señal es la que se utiliza hoy en dia para expresar que en ese lugar en el que se encuentra la señal hay radiactividad y por tanto hay que tener cuidado)
d) Aportaciones del matrimonio Joliot y Marie Curie y Rutherford en la radiactividad: Fueron unas aportaciones muy importantes y decisivas en el trabajo de Becquerel, pues él había descubierto la radiactividad (denominado así por el matrimonio de Joliot y Marie Curie) pero no sabía realmente lo que era hasta que Joliot, Marie Curie y Rutherford no dejaron claro, explicando la radiactividad de forma más técnica, lo que ésta suponía y significaba.Fue descubierta por Becquerel con un poco de suerte, y definido de forma más científica por el matrimonio de Marie Curie. Se habla de suerte, puesto que Becquerel quería exponer al Sol una placa fotográfica cubierta con papel negro, sobre el que ponía una moneda. Todo ésto luego lo recubría con sal de uranio. Como estabamos diciendo, lo quería exponer a la luza solar, puesto que tenía que dar una charla en la Academia y quería enseñarles a los
 oyentes los efectos de la fosforescencia, pero los últimos dias habian estado muy nublados, por lo que no pudo exponer su placa fotográfica al Sol, cuando fué a mirar tan solo para mostrar los efectos de la fosforescencia débil, se dió cuenta de que la moneda salía tan nítida como si hubiese sido expuesta a la luz solar. De esta manera descubrió Becquerel la radiactividad sin tener constancia de la impotancia de su descubrimiento hasta la definición del mismo por parte del matrimonio Curie, como hemos dicho antes.
oyentes los efectos de la fosforescencia, pero los últimos dias habian estado muy nublados, por lo que no pudo exponer su placa fotográfica al Sol, cuando fué a mirar tan solo para mostrar los efectos de la fosforescencia débil, se dió cuenta de que la moneda salía tan nítida como si hubiese sido expuesta a la luz solar. De esta manera descubrió Becquerel la radiactividad sin tener constancia de la impotancia de su descubrimiento hasta la definición del mismo por parte del matrimonio Curie, como hemos dicho antes.(Esta señal es la que se utiliza hoy en dia para expresar que en ese lugar en el que se encuentra la señal hay radiactividad y por tanto hay que tener cuidado)
e) Alfa, gamma y beta: Alfa, gamma y beta son distintos tipos de radiaciones, son los tres tipos de de emisiones en las que se descompone la radiactividad. Las primeras en ser descubiertas fueron alfa y beta, descubiertas por Rutherford. Éste se dió cuenta de que los elementos radiactivos emitían dos tipos de rayos a los que denominó por los nombres anteriormente citados, alfa y beta. Después ya en la universidad de Canadá se dió cuenta de que no se emitían dos tipos de rayos, si no tres: alfa, gamma y beta.
La radiación gamma es la más energética de la tres, es una radiación que tiene una altísima frecuencia, pero como consecuencia, una cortísima longitud de onda. Después, en orden de mayor a menor, se sitúa la radiación beta, que es un flujo de electrones, y en último lugar, como radiación menos energética, se situaría la radiación alfa, que eran átomos de helio doblemente ionizados (H++) (esté tipo de rayos fue el que utilizó Rutherford para llevar a cabo quizá su experimento más conocido, el de bombardear una lamina de oro con partículas alfa, experimento tras el cúal consigió deducir que en un átomo, los electrones se encontraban en una capa separada del núcleo, y no dentro del mismo como dijo Thomson). Estas partículas tambien se podían obtener colocando una fuente radiactiva intensa en un contenedor de plomo con una pequeña abertura.
 En esta otra foto se puede observar con gran facilidad el nivel de energía que posee cada una.
En esta otra foto se puede observar con gran facilidad el nivel de energía que posee cada una.f) La ley de la desintegración atómica: Es el ritmo con el que los átomos de una muestra radiactiva se desintegran. Determinó que la vida media de estos átomos podía estar entre unos pocos segundos, en el caso de algunos átomos, hasta miles de millones de años, como era el caso de otros. Esta enorme variación se podía predecir gracias a la ley de la desintegración atómica.
A demás de estos átomos que se desintegraban, había otros (como es el caso del uranio) que muy lentamente se transformaban en otros elementos, que a su vez se desintegraban llegando siempre hasta un mismo final en la cadena, el plomo.
Rutherford utilizó muestras geológicas que contuvieran estos elementos, puesto que conociendo a qué ritmo se desintegraba cada uno, podía establecer un límite inferior a la edad de la Tierra. Éste es un método de datación que en la época actual se sigue utilizando.
Trabajo sobre el carbono 14.
El carbono 14 es un radioisótopo* del carbono, descubierto por Martin Kamen y Sam Ruben en el 27 de febrero de 1940. Este isótopo del carbono tiene 8 neutrones frente a los 6 que tiene un átomo de carbono.
Este isótopo es producido de forma continúa en la atmósfera como consecuencia de un bombardeo de átomos de nitrógeno por neutrónes cósmicos. Al ser un átomo tan inestable, se encuentra mezclado con los elementos no radiactivos en el dióxido de carbono de la atmósfera.
El carbono 14 es un átomo muy útil para fechar la edad de restos de seres vivos, con una antigüedad de hasta 10.000 años.
*Un isótopo es una variante de un elemento, el cual se diferencia con el principal, en el número de neutrones que hay en su núcleo. Un radioisótopo o isótopo radiactivo de un elemento se caracteriza por tener un núcleo atómico inestable (debido a la diferencia entre protones y neutrones dentro del núcleo), son átomos que emiten energía cuando pasan de ese estado inestable a otro estado un poco más estable. Estos radioisótopos se pueden medir con el contador de Geiger.
g) El contador Geiger: El contador Geiger es un instrumento que sirve para medir la radiactividad de un objeto o lugar. Está formado por un tubo metálico con hilio también metálico muy fino en su interior, a lo largo de su centro. Dentro del tubo, se encuentra el gas argón a una presión de 260mmHg mezclado con vapor de etano o neón, y con vapor de bromo.
La diferencia entre el ánodo (el pequeño hilo que va por dentro del tubo) y el cátodo (las paredes del tubo) es muy alta (entre 500 y 1200 V), por lo que cuando hay una alta radiación, el gas que se encuantra dentro del tubo, se ioniza y se produce un breve flujo de corriente establecido entre los electrodos. El flujo será el que nos indique la cantidad de radiactividad que hay en un determinado lugar u objeto, siendo mayor el flujo cuanta más radiactividad haya.
A demás de estos átomos que se desintegraban, había otros (como es el caso del uranio) que muy lentamente se transformaban en otros elementos, que a su vez se desintegraban llegando siempre hasta un mismo final en la cadena, el plomo.
Rutherford utilizó muestras geológicas que contuvieran estos elementos, puesto que conociendo a qué ritmo se desintegraba cada uno, podía establecer un límite inferior a la edad de la Tierra. Éste es un método de datación que en la época actual se sigue utilizando.
Trabajo sobre el carbono 14.
El carbono 14 es un radioisótopo* del carbono, descubierto por Martin Kamen y Sam Ruben en el 27 de febrero de 1940. Este isótopo del carbono tiene 8 neutrones frente a los 6 que tiene un átomo de carbono.
Este isótopo es producido de forma continúa en la atmósfera como consecuencia de un bombardeo de átomos de nitrógeno por neutrónes cósmicos. Al ser un átomo tan inestable, se encuentra mezclado con los elementos no radiactivos en el dióxido de carbono de la atmósfera.
El carbono 14 es un átomo muy útil para fechar la edad de restos de seres vivos, con una antigüedad de hasta 10.000 años.
*Un isótopo es una variante de un elemento, el cual se diferencia con el principal, en el número de neutrones que hay en su núcleo. Un radioisótopo o isótopo radiactivo de un elemento se caracteriza por tener un núcleo atómico inestable (debido a la diferencia entre protones y neutrones dentro del núcleo), son átomos que emiten energía cuando pasan de ese estado inestable a otro estado un poco más estable. Estos radioisótopos se pueden medir con el contador de Geiger.
g) El contador Geiger: El contador Geiger es un instrumento que sirve para medir la radiactividad de un objeto o lugar. Está formado por un tubo metálico con hilio también metálico muy fino en su interior, a lo largo de su centro. Dentro del tubo, se encuentra el gas argón a una presión de 260mmHg mezclado con vapor de etano o neón, y con vapor de bromo.
La diferencia entre el ánodo (el pequeño hilo que va por dentro del tubo) y el cátodo (las paredes del tubo) es muy alta (entre 500 y 1200 V), por lo que cuando hay una alta radiación, el gas que se encuantra dentro del tubo, se ioniza y se produce un breve flujo de corriente establecido entre los electrodos. El flujo será el que nos indique la cantidad de radiactividad que hay en un determinado lugar u objeto, siendo mayor el flujo cuanta más radiactividad haya.

Con la frase: "es como si se disparara un obus naval de buen calibre sobre una hoja de papel y rebotara". Ésta frase fue enunciada por Rutherford sin antes tener en cuenta la propiedad que acabamos de indicar y pensando según el modelo atómico de Thomson. Él lo que vio fue que cómo un pedazo partícula cargadísima de energía y con gran potencial podía ser rebotada por una simple finísima lámina de oro. No era normal pues se entiende o se había entendido hasta ahora con la mica que lo que ocurría es que lo rompía y no podía rebotar. Como bien indica lo lógico es que el obus rompa en cachos la hoja pero lo que no es normal es que rebote. Como hemos indicado Rutherford no tuvo en cuenta pues no había calculado todavía nada acerca del núcleo y no sabía que la suma de las energías de los protones del núcleo era tan grande que podía hacer competencia a la de las alfa. Esto fue una frase célebre pues se hizo cuestionar que narices pasaba ahí que no era normal, lo primero no se estaban rompiendo átomos y lo segundo lo negativo no podía estar pegado a lo positivo porque si no no hay manera que rebote y gracias al enunciamiento de ésta frase consiguió
 un nuevo modelo atómico. Es una frase célebre porque hace razonar a la gente y da un significado irónico como diciendo que aquí pasa algo raro que no es normal.
un nuevo modelo atómico. Es una frase célebre porque hace razonar a la gente y da un significado irónico como diciendo que aquí pasa algo raro que no es normal. Aqui he un video que explica el experimento de rutherford. Aunque viene en inglés viene a decir lo mismo que hemos explicado.
6.Para explicar estos hechos, Rutherford propuso el modelo atómico nuclear que sitúa la mayor parte de la masa de átomo concentrada en una zona my pequeña del mismo (contra la que chocaban las partículas desviadas). El modelo supone que el resto del átomo esta prácticamente vacío.
Modelo atómico nuclear
El modelo atómico nuclear distingue dos partes en el átomo: el núcleo y la corteza.
El núcleo. Es muy pequeño en comparación con el volumen total del átomo y concentra casi toda su masa. Consta de dos tipos de partículas: los protones con carga eléctrica positiva y los neutrones eléctricamente neutros. El núcleo, tiene por tanto, carga eléctrica positiva. La masa del neutrón es ligeramente superior a la del neutrón
La corteza. Es la zona donde los electrones se mueven en torno al núcleo.
Los electrones tienen carga eléctrica negativa. La masa del electrón es unas 2000 veces menor que la del protón.
Los átomos contienen el mismo número de electrones en la corteza que de protones en el núcleo; en consecuencia, son eléctricamente neutros.
6.Para explicar estos hechos, Rutherford propuso el modelo atómico nuclear que sitúa la mayor parte de la masa de átomo concentrada en una zona my pequeña del mismo (contra la que chocaban las partículas desviadas). El modelo supone que el resto del átomo esta prácticamente vacío.
Modelo atómico nuclear
El modelo atómico nuclear distingue dos partes en el átomo: el núcleo y la corteza.
El núcleo. Es muy pequeño en comparación con el volumen total del átomo y concentra casi toda su masa. Consta de dos tipos de partículas: los protones con carga eléctrica positiva y los neutrones eléctricamente neutros. El núcleo, tiene por tanto, carga eléctrica positiva. La masa del neutrón es ligeramente superior a la del neutrón
La corteza. Es la zona donde los electrones se mueven en torno al núcleo.
Los electrones tienen carga eléctrica negativa. La masa del electrón es unas 2000 veces menor que la del protón.
Los átomos contienen el mismo número de electrones en la corteza que de protones en el núcleo; en consecuencia, son eléctricamente neutros.
Según el modelo atómico de Rutherford, los electrones se mueven en órbitas circulares y tienen una aceleración normal.Una carga eléctrica emite energía; por lo tanto, el electrón terminaría describiendo órbitas en espiral hasta chocar con el núcleo, y esto supondría una pérdida continua de energía.
Por otro lado, el electrón pasaría por todas las órbitas posibles describiendo una espiral alrededor del núcleo; y por tanto, la radiación emitida debería de ser continua. Sin embargo, los espectros de emisión de los elementos son discontinuos.
Por otro lado, el electrón pasaría por todas las órbitas posibles describiendo una espiral alrededor del núcleo; y por tanto, la radiación emitida debería de ser continua. Sin embargo, los espectros de emisión de los elementos son discontinuos.
A Rutherford se le considera el padre de la interacción nuclear ya que gracias
a sus investigaciones acerca de las interacciones. Según la interacción nuclear fuerte la fuerza obliga a los núcleos a permanecer unidos.
a sus investigaciones acerca de las interacciones. Según la interacción nuclear fuerte la fuerza obliga a los núcleos a permanecer unidos.
A continuación explicaremos las 4 interacciones fundamentales de la naturaleza.
Existen cuatro tipos de interacciones fundamentales: interacción nuclear fuerte, interacción nuclear débil, interacción electromagnética e interacción gravitatoria.
Existen cuatro tipos de interacciones fundamentales: interacción nuclear fuerte, interacción nuclear débil, interacción electromagnética e interacción gravitatoria.
Interacción gravitatoria. Se da entre todas las partículas y se describe mediante la teoría de la relatividad general de A. Einstein o más fácilmente mediante la ley de gravitación universal de Isaac Newton. Gracias a ella se pueden explicar fenómenos como la caída de los cuerpos o el movimiento de los planetas, satélites, estrellas, cometas, etc. Su alcance es infinito y actúa a grandes distancias. Es la interacción más débil de todas, pero es la responsable de la estructura general del Universo.
Interacción electromagnética. La interacción electromagnética afecta a las partículas con carga eléctrica o con momento magnético, así como a los fotones. Su descripción se hace a partir de las leyes de Maxwell y su alcance es infinito. Gracias a ella se pueden explicar fenómenos tan diversos como los eléctricos, los magnéticos, la interacción entre la luz y la materia, las ondas electromagnéticas, la estructura interna de la materia a escala atómica y molecular, así como la química.
Interacción electromagnética. La interacción electromagnética afecta a las partículas con carga eléctrica o con momento magnético, así como a los fotones. Su descripción se hace a partir de las leyes de Maxwell y su alcance es infinito. Gracias a ella se pueden explicar fenómenos tan diversos como los eléctricos, los magnéticos, la interacción entre la luz y la materia, las ondas electromagnéticas, la estructura interna de la materia a escala atómica y molecular, así como la química.
Interacción nuclear fuerte. La interacción nuclear fuerte afecta a los quarks, y por tanto, a los hadrones. Es la más intensa de las cuatro y se denomina también interacción fuerte o interacción hadrónica. No tiene influencia en la Química, por ejemplo. Gracias a esta interacción se puede explicar la estabilidad nuclear y muchos procesos nucleares.
Interacción nuclear débil. La interacción nuclear débil se produce entre partículas leptónicas o hadrónicas. Explica algunos procesos nucleares, como la desintegración de los núcleos, en la que un neutrón se transforma en un protón y un electrón, generándose también un antineutrino electrónico. También explica las transformaciones entre leptones, como la desintegración del tauón. Su intensidad es mucho mayor que la fuerza gravitatoria, pero es menor que la fuerza electromagnética. También se denomina interacción débil.
7. Explicación del escudo
En primer lugar hemos elegido este fondo porque es de color de oro como es el elemento que eligió Rutherford para llevar a cabo su experimento.
Hemos preferido que el escudo este sobre el mundo por 2 razones: la primera porque es y va a ser uno de los científicos mas grandes de este mundo, la segunda porque el modelo que dio de la estructura del átomo se parece al sistema solar. Por último en el centro del escudo pusimos una foto de Rutherford, que es en definitiva en lo que se basa este trabajo.
Las frases en latín quieren decir dos cosas que pueden ser algunos de los principios que siguen los físicos y que impulsan su curiosidad:
Hemos preferido que el escudo este sobre el mundo por 2 razones: la primera porque es y va a ser uno de los científicos mas grandes de este mundo, la segunda porque el modelo que dio de la estructura del átomo se parece al sistema solar. Por último en el centro del escudo pusimos una foto de Rutherford, que es en definitiva en lo que se basa este trabajo.
Las frases en latín quieren decir dos cosas que pueden ser algunos de los principios que siguen los físicos y que impulsan su curiosidad:
Ad eundum quo nemo ante iit: Ir osadamente donde nadie ha llegado jamás. Ad altiora tendimus: A lo alto tendemos.