REACCIONES QUÍMICAS.
OBTENCIÓN DE SUSTANCIAS GASEOSAS. 

Autores: Jorge González, Juan Maroñas y Daniel Benatar.
Fecha: 4/11/08 en el laboratorio
Lugar: Laboratorio
2.-Resumen
Esta práctica consiste en la obtención de sustancias gaseosas mediante reacciones químicas. En este caso hemos escogido el gas hidrogeno, el dióxido de nitrógeno y el amoniaco.
En primer lugar para la obtención del gas hidrogeno necesitamos acido clorhídrico, zinc y un globo. En el globo recogeríamos el gas que se produce y así analizar sus propiedades.
A continuación nuestro objetivo era la obtención de dióxido de nitrógeno. Nuestro objetivo era hacer una disolución entre el acido nítrico y el cobre para obtener el dióxido de nitrógeno. Después repetimos el proceso añadiendo agua.
Para eso necesitamos el acido nítrico y cobre, además necesitamos un medidor de ph.
En último lugar para la obtención del amoniaco hicimos una disolución entre el agua y una perla de sosa. Posteriormente añadimos cloruro amonico y lo calentamos con el mechero bunsen.
Los objetivos de el trabajo son la observación de propiedades muy curiosas de las reacciones químicas que vamos a realizar y también el conocimiento de sustancias peligrosas y del modo de uso que se debe hacer de ellas. Las conclusiones que tenemos en un principio son que hay sustancias que al mezclarlas con otras producen reacciones y procesos muy curiosos e interesantes y que a pesar de ello son muy peligrosas en algunos casos.
3.-Introducción
Esta es la segunda práctica que hacemos en el laboratorio. En esta práctica llevaremos a cabo la obtención de sustancias gaseosas mediante reacciones químicas. Lo realizamos en el laboratorio de Química y Física y lo hemos realizado para observar propiedades de sustancias al hacerlas reaccionar con otras cosas y las sustancias que surgen de las reacciones. Partimos de unas condiciones no muy exactas pues hay que tener en cuenta en las reacciones que influirá la presión atmosférica así como el conjunto de gases que se encuentran en la atmósfera: por ejemplo el NO se oxida rápidamente a O2. Como en todas las prácticas, antes tenemos que saber unos conocimientos básicos como que las reacciones químicas, que pueden ser de 2 tipos, exotérmicas cuando desprenden energía y endotérmicas cuando la absorben. Es importante saber la ley de conservación de la masa de Lavoisier. Consiste: en toda reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos. Otra cosa que aprendimos es que una disolución es una mezcla homogénea entre dos sustancias un soluto (menor cantidad) y un disolvente (el medio en el que se disuelve)
Finalmente aprendimos unas medidas de seguridad, para manipular sustancias perjudiciales o peligrosas.
4. - TRABAJO EXPERIMENTAL
En este apartado daremos algunos detalles sobre la práctica, así como los métodos que se han llevado a cabo para realizar esta práctica, los diferentes reactivos utilizados y los productos a los que nos han conducido, y los instrumento que han sido utilizados.
1.obtención del gas hidrógeno (H2) Esta es la primera parte de la práctica, en la que tratamos de conseguir mediante una reacción entre el zinc (Zn) y el ácido clorhídirco (HCl), cloruro de zinc (ZnCl2) y gas hidrógeno (H2).
Esta es la segunda parte de la práctica, donde juntando cobre (Cu) con ácido nítrico (HNO3), obtenemos nitrato cúprico [Cu(NO3)], monóxido de nitrógeno (NO) y agua (H2O).
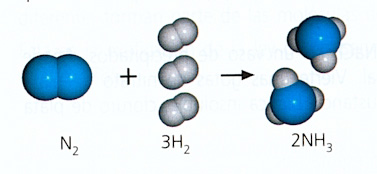
3. Obtención de amoniaco
Esta es la tercera y última parte de la práctica del laboratorio. En esta parte lo que se pretende es mediante el cloruro amónico (NH4Cl) y la sosa (NaOH), que reaccionen entre ambos, y forme el cloruro de sodio (NaCl), amoniaco (NH3) y agua (H2O).
INSTRUMENTOS UTILIZADOS
Para poder realizar esta última parte necesitamos:
· Un nuevo tubo de ensayo.
· Un mechero bunsen para calentar la reacción.
· Unas pinzas.
REACTIVOS Y PRODUCTOS
Los reactivos que vamos a utilizar en esta reacción son el cloruro amónico (NH4Cl) y la sosa o hidróxido sódico (NaOH) que al reaccionar entre ellos, dara lugar a los productos que hemos dicho antes, el cloruro de sodio (NaCl), el amoniaco (NH3) y el agua (H2O).
Lo primero que hay que hacer es coger un tubo de ensayo limpio en el que hay que ponerle una pequeña cantidad de agua y una perla de sosa. Esto da lugar a una disolución de sosa en la que el agua es el disolvente y la sosa es el soluto. Anota lo que ves que pasa en la disolución.
Añade después una pequeña cantidad de cloruro amónico y calienta con el mechero bunsen el tubo de ensayo en el que se está haciendo la reacción (esto sirve para acelerar la reacción). Hay que anotar todo lo que pasa en el tubo de ensayo, cambios, olores, etc.
5. - RESULTADOS OBTENIDOS En este apartado vamos a explicar los resultados que han salido tras haber hecho la práctica.
CUESTIONES :
1. Zn + HCl -> ZnCl2 + H2 => Zn + 2HCl -> ZnCl2 + H2
RESULTADOS DEL TRABAJO:
OBTENCIÓN DEL GAS HIDRÓGENO:
Cuando añadimos el Zn al HCl vemos que en la reacción salen burbujas del Zn que se está consumiendo y sale un gas que podemos ver y que huele como a bomba fétida lo que nos puede sugerir que éstas se hagan con reacciones de este tipo. Vemos que si tocamos la base del tubo de ensayo ésta está caliente lo que nos indica que es una reacción exotérmica en la que se produce calor. Una vez puesto el globo vemos que éste se hincha y por la reacción sabemos que es gas hidrógeno. Lo que huele mal no es el gas H pues nos hemos informado y hemos visto que éste es inoloro así que el olor vendrá de la reacción que produce el HCl. Teóricamente si soltamos el globo éste debería subir lo que ocurre es que como hay muy poco H y el globo pesa bastante pues no conseguimos que ascienda. Subiría pues el H es menos denso que el airel. Una cosa curiosa que observamos es que si le prendemos fuego al globo éste estalla. Esto nos puede indicar que así se consigan las bombas de H tan famosas aunque no creo pues tiene algo que ver a nivel nuclear.
OBTENCIÓN DE DIÓXIDO DE NITRÓGENO:
Cuando añadimos a una pieza de cobre, HNO3 lo primero que observamos es que el Cu empieza a burbujear pues está reaccionando y el líquido que resulta de la reacción se torna verde y empieza a surgir un humillo amarillo/anaranjado que sería el NO. Esto fue lo que pensamos en un principio pero hemos descubierto que el NO es incoloro y por tanto el gas amarillo o es NO2 o es un gas que surge de la reacción. Vemos que nada más salir el gas del tubo de ensayo, éste tiende a irse contra la mesa pues es más denso que el aire y portanto baja hacia abajo. Vemos que el tubo también está caliente luego será una pequeña reacción exotérmica. Hemos escuchado que suena al reaccionar y el olor es el del cloro de la piscina. Si lo medimos con un medidor de Ph vemos que se torna completamente rojo lo (esto es gas nitrogeno que se vierte a la atmósfera, NO2) que nos indica que es una sustancia muy ácida. Si le echamos agua observamos que el papelito se tiñe rojo pero menos pues el agua lo que hace no es bajar el Ph sino aumentar la disolución y que ésta esté menos concentrada lo que concuerda con que sea menos rojo pues las moleculas de sustancia ácida que caerán serán menores. Al hacer esto hemos "reducido su acidez" y por tanto lo podremos echar en el recipiente de residuos. La sustancia se vuelve azul. (en este video se puede ver el proceso explicado)
empieza a surgir un humillo amarillo/anaranjado que sería el NO. Esto fue lo que pensamos en un principio pero hemos descubierto que el NO es incoloro y por tanto el gas amarillo o es NO2 o es un gas que surge de la reacción. Vemos que nada más salir el gas del tubo de ensayo, éste tiende a irse contra la mesa pues es más denso que el aire y portanto baja hacia abajo. Vemos que el tubo también está caliente luego será una pequeña reacción exotérmica. Hemos escuchado que suena al reaccionar y el olor es el del cloro de la piscina. Si lo medimos con un medidor de Ph vemos que se torna completamente rojo lo (esto es gas nitrogeno que se vierte a la atmósfera, NO2) que nos indica que es una sustancia muy ácida. Si le echamos agua observamos que el papelito se tiñe rojo pero menos pues el agua lo que hace no es bajar el Ph sino aumentar la disolución y que ésta esté menos concentrada lo que concuerda con que sea menos rojo pues las moleculas de sustancia ácida que caerán serán menores. Al hacer esto hemos "reducido su acidez" y por tanto lo podremos echar en el recipiente de residuos. La sustancia se vuelve azul. (en este video se puede ver el proceso explicado)
OBTENCIÓN DE AMONIACO:
Cuando añadimos sosa disuelta en agua a el NH4Cl (cloruro amónico) vemos que la sosa se empieza a disolverse por completo pues con el agua estaba medio disuelta pero añadimos una fuente de calor con el mechero bunsen para acelerar la disolución y la reacción. Vemos que hay particulas que suben que probablemente sea un gas y que al olerlo pica la nariz. Huele a amoniaco que es uno de los productos de la reacción. El cloruro amónico se disuelve y luego hay algo que se evapora pues aparece un gas.
6.CONCLUSIONES: Al principio nos planteamos como objetivos el desarrollar habilidades básicas en el laboratorio de química y física (por ejemplo descubrir que no se un juego y que puede sin control resultar peligroso, normas de seguridad, uso del material y tratamiento correcto de las sustancias). También nos planteamos usar de forma práctica nuestros conocimientos de química inorgánica aplicada y por último el concepto de reacción química. Hemos introducido el ajuste de reacciones químicas mediante métodos estequiométricos. Hemos visto lo que era un producto y un reactivo y el concepto de disolución. Los objetivos han sido cumplidos. La diferencia básica entre disolución y reacción es que en una disolución las sustancias utilizadas al mezclarlas siguen siendo las mismas mientras que en una reacción aparecen sustancias nuevas. En este trabajo hemos obtenido gases a partir de distintas reacciones químicas y hemos observado lo que ocurría y sacado conclusiones. Nuestra conclusión ha sido parecida a la que teníamos anteriormente pues sabíamos que iban a ocurrir cosas muy curiosas. Hemos descubierto que a partir de un ácido y un metal se pueden conseguir gases como el H que al prenderlos estallen y que durante el proceso químico de obtención ocurran cosas interesantes como el olor producido. También hemos observado que se puede conseguir gases como el NO, en el cual observamos que el agua se teñía y que surgía un gas amarillo misterioso que no es el N (hemos visto en internet que el NO es incoloro). Finalmente hemos visto una manera de obtener NH3 y observado que si lo olemos pica mucho la nariz.
7.BIBLIOGRAFÍA:
Hemos utilizado el google y la wikipedia y las notas tomadas en nuestro cuaderno así como la información contenida en éste.
8.AGRADECIMIENTOS:
Debemos agradecerselo a Ángel pues el nos ha ayudado a utilizar las sustancias peligrosas que nosotros no conocíamos y que sin su ayuda podría habernos causado daño. También nos a explicado como utilizarlas.
OBTENCIÓN DE SUSTANCIAS GASEOSAS.



Autores: Jorge González, Juan Maroñas y Daniel Benatar.
Fecha: 4/11/08 en el laboratorio
Lugar: Laboratorio
2.-Resumen
Esta práctica consiste en la obtención de sustancias gaseosas mediante reacciones químicas. En este caso hemos escogido el gas hidrogeno, el dióxido de nitrógeno y el amoniaco.
En primer lugar para la obtención del gas hidrogeno necesitamos acido clorhídrico, zinc y un globo. En el globo recogeríamos el gas que se produce y así analizar sus propiedades.
A continuación nuestro objetivo era la obtención de dióxido de nitrógeno. Nuestro objetivo era hacer una disolución entre el acido nítrico y el cobre para obtener el dióxido de nitrógeno. Después repetimos el proceso añadiendo agua.
Para eso necesitamos el acido nítrico y cobre, además necesitamos un medidor de ph.
En último lugar para la obtención del amoniaco hicimos una disolución entre el agua y una perla de sosa. Posteriormente añadimos cloruro amonico y lo calentamos con el mechero bunsen.
Los objetivos de el trabajo son la observación de propiedades muy curiosas de las reacciones químicas que vamos a realizar y también el conocimiento de sustancias peligrosas y del modo de uso que se debe hacer de ellas. Las conclusiones que tenemos en un principio son que hay sustancias que al mezclarlas con otras producen reacciones y procesos muy curiosos e interesantes y que a pesar de ello son muy peligrosas en algunos casos.
3.-Introducción
Esta es la segunda práctica que hacemos en el laboratorio. En esta práctica llevaremos a cabo la obtención de sustancias gaseosas mediante reacciones químicas. Lo realizamos en el laboratorio de Química y Física y lo hemos realizado para observar propiedades de sustancias al hacerlas reaccionar con otras cosas y las sustancias que surgen de las reacciones. Partimos de unas condiciones no muy exactas pues hay que tener en cuenta en las reacciones que influirá la presión atmosférica así como el conjunto de gases que se encuentran en la atmósfera: por ejemplo el NO se oxida rápidamente a O2. Como en todas las prácticas, antes tenemos que saber unos conocimientos básicos como que las reacciones químicas, que pueden ser de 2 tipos, exotérmicas cuando desprenden energía y endotérmicas cuando la absorben. Es importante saber la ley de conservación de la masa de Lavoisier. Consiste: en toda reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos. Otra cosa que aprendimos es que una disolución es una mezcla homogénea entre dos sustancias un soluto (menor cantidad) y un disolvente (el medio en el que se disuelve)
Finalmente aprendimos unas medidas de seguridad, para manipular sustancias perjudiciales o peligrosas.
4. - TRABAJO EXPERIMENTAL
En este apartado daremos algunos detalles sobre la práctica, así como los métodos que se han llevado a cabo para realizar esta práctica, los diferentes reactivos utilizados y los productos a los que nos han conducido, y los instrumento que han sido utilizados.
1.obtención del gas hidrógeno (H2) Esta es la primera parte de la práctica, en la que tratamos de conseguir mediante una reacción entre el zinc (Zn) y el ácido clorhídirco (HCl), cloruro de zinc (ZnCl2) y gas hidrógeno (H2).
INSTRUMENTOS UTILIZADOS
Para llevar a cabo esta primera parte de la práctica se necesitan:
· Un tubo de ensayo al que se le introducen los reactivos y ver lo que sucede.
· Un globo para tapar el tubo de ensayo y recoger el gas producido por la reacción.
· Una pipeta.
· Un mechero y una cerilla larga para quemar el globo.
REACTIVOS Y PRODUCTOS
Los reactivos que hay que utilizar son el zinc (Zn), un metal de color grisáceo y el ácido clorhídrico (HCl), un líquido incoloro. Los productos obtenidos el reaccionar estos dos elementos son el cloruro de zinc (ZnCl2), en el líquido que queda en el fondo del tubo de ensayo, y gas hidrógeno (H2) dentro de el globo.MÉTODOS
Primero hay que coger el tubo de ensayo y echarle un poco de ácido clorhídrico con una pipeta limpia. Despues de haberle hechado el ácido clorhídrico, hay que echar una pequeña pieza de de zinc y rápidamente taparlo con un globo para atrapar el gas producido por la reacción entre el ácido clorhídrico y el zinc pues ésta es practicamente instantanea. Anotamos todo lo que veamos que ocurre dentro del tubo y cuando haya acabado la reacción, hay que sacar el globo y atarlo, soltarlo y ver que ocurre. Por último hay que someter el globo lleno del gas producido por la reacción (gas hidógeno) al calor del fuego y anotar lo que ocurre al hacer esto.
2. Obtención del dióxiodo de nitrógeno (NO2)
Esta es la segunda parte de la práctica, donde juntando cobre (Cu) con ácido nítrico (HNO3), obtenemos nitrato cúprico [Cu(NO3)], monóxido de nitrógeno (NO) y agua (H2O).
INSTRUMENTOS UTILIZADOS
Para realizar esta segunda parte necesitamos:
· Un nuevo tubo de ensayo como lugar para realizar la reacción.
· Una pipeta para echar el ácido nítrico.
· Un papelito indicador del pH para medir el pH de las sustancias al finalizar la reacción.
· Una varilla de cristal para para añadir unas gotas de las sustancias obtenidas tras la reacción al papel del pH.
· Un vaso de precipitados para verter el contenido del tubo de ensayo.
· Un recipiente de residuos para verter el contenido del vaso de precipitados.
REACTIVOS Y PRODUCTOS
Los reactivos que se necesitan son un par de piezas de cobre (Cu) y un poco de ácido nítrico (HNO3). Los productos obtenidos tras la reacción entre los reactivos, son el nitrato cúprico (Cu3N2), monóxido de nitrógeno (NO), el cual se oxida rápidamente a dióxido de nitrógeno (NO2) debido al contacto con la atmósfera, y agua (H2O).
MÉTODOS
Se le echa una pequeña cantidad de ácido nítrico al tubo de ensayo y despues se le añade unas piezas de cobre, y se anota todo lo que veamos que esté sucediendo dentro del tubo de ensayo.
Cuando la reacción haya acabado, con la varilla de vidrio, hay que coger unas gotas de la sustncia obtenida, medir su pH con el papelito indicador y anotarlo. Cuando ésto ya este hecho, hay que coger el tubo de ensayo y verter todo su contenido dentro de un vaso de precipitados, añadiendole unas gotas de agua.Tras haberselas añadido hay que volver a medir su pH con otra varilla de cristal y otro papelito. Cuando el pH sea neutro, hay que echar el líquido en el recipiente para los residuos ya que contiene metales pesados (el cobre) y en muy contaminante, lo cual no se puede tirar por el desagüe.
3. Obtención de amoniaco
Esta es la tercera y última parte de la práctica del laboratorio. En esta parte lo que se pretende es mediante el cloruro amónico (NH4Cl) y la sosa (NaOH), que reaccionen entre ambos, y forme el cloruro de sodio (NaCl), amoniaco (NH3) y agua (H2O).
INSTRUMENTOS UTILIZADOS
Para poder realizar esta última parte necesitamos:
· Un nuevo tubo de ensayo.
· Un mechero bunsen para calentar la reacción.

· Unas pinzas.
REACTIVOS Y PRODUCTOS
Los reactivos que vamos a utilizar en esta reacción son el cloruro amónico (NH4Cl) y la sosa o hidróxido sódico (NaOH) que al reaccionar entre ellos, dara lugar a los productos que hemos dicho antes, el cloruro de sodio (NaCl), el amoniaco (NH3) y el agua (H2O).
MÉTODOS
Lo primero que hay que hacer es coger un tubo de ensayo limpio en el que hay que ponerle una pequeña cantidad de agua y una perla de sosa. Esto da lugar a una disolución de sosa en la que el agua es el disolvente y la sosa es el soluto. Anota lo que ves que pasa en la disolución.
Añade después una pequeña cantidad de cloruro amónico y calienta con el mechero bunsen el tubo de ensayo en el que se está haciendo la reacción (esto sirve para acelerar la reacción). Hay que anotar todo lo que pasa en el tubo de ensayo, cambios, olores, etc.
5. - RESULTADOS OBTENIDOS En este apartado vamos a explicar los resultados que han salido tras haber hecho la práctica.
CUESTIONES :
1. Zn + HCl -> ZnCl2 + H2 => Zn + 2HCl -> ZnCl2 + H2
Cu + HNO3 => Cu(NO3)2 + NO + H2O +O2(pues el monoxido de nitrógeno se oxida rápidamente) => 2Cu + 6HNO3 => 2Cu(NO3) + 2N0 + 3H2O + 1/2O2
NH4Cl + NaOH -> NaCl + NH3 + H2O => está ajustada
2. Reactivos y productos:· Los reactivos son las sustancias iniciales que son modificadas por las reacciones químicas.
· Los productos son las sustancias que han surgido tras la reacción química.
En la primera parte, los reactivos son el zinc y el ácido clorhídrico que son las sustancias sometidas a la reacción y los productos son el cloruro de zinc y el gas hidrógeno.En la segunda parte, los reactivos son el cobre y el ácido nítico mientras que los productos son el nitrato cúprico, el monóxido de nitrógeno y el agua.
Y por último en la tercera parte, los reactivos son el cloruro amónico y la sosa. Los productos son el cloruro de sodio, el amoniaco y el agua.
3. Solamente hemos realizado una disolución en la tercera parte de la práctica. Hemos diluido una perla de sosa en agua para poder luego realizar una reacción química con el cloruro amónico. En esta disolución la sosa es el soluto ya que está en menor medida y el agua es el disolvente en el que hemos disuelto la sosa.
4. La reacción más exotérmica realizada en esta práctica es la primera reacción del zinc y el ácido clorhídrico. Si una reacción es exotérmica o no, se puede apreciar tocando el culo del tubo de ensayo al terminar la reacción. Si éste está caliente es que la reacción es exotérmica y por el otro lado, si el tubo de ensayo no está caliente, es que la reacción es isotérmica.
La segunda reacción (cobre + ácido nítrico) tambien es exotérmica, aunque en menor medida que la primera, puesto que el tubo de ensayo se calienta menos.
5. El primer gas que obtenemos es el gas hidrógeno (H2), es un gas menos denso que el aire puesto que por lo que se puede observar al almacenarlo en un globo y soltarlo, el globo asciende. Y es tambien un gas altamente inflamable, puesto que al quemarlo se produce una pequeña esplosión.
(Este video lo han hecho dos personas que no tenían muy claro los problemas que tiene el hidrógeno al quemarse y no toman ningun tipo de medida de seguridad, a pesar de eso, hemos elegido este video porque nos parecia que se veía muy bien como se producía una pequeña esplosión al quemarse el gas)
El segundo gas que obtenemos es el monóxido de nitrógeno. Este es un gas que al proceder de la reacción tiene un color amarillento/anaranjado, (esto es lo que pensamos al observarlo) es un gas mucho más denso que el aire, puesto que cuando sale del tubo de ensayo, se ve que no se esparce por el aire, si no que se mantiene junto (puesto que es más denso) y por tanto va hacia abajo acumulándose allí. La mesa hace tope y eso nos da la sensación de que se mantenga mas junto.
6. El gas hidrógeno es un gas incoloro, inoloro e insípido, compuesto por partículas diatómicas (H2). Las principales utilizaciones que tiene el hidrógeno es para la obtención del amoniaco y para la refinación de combustibles fósiles como el petróleo.
El monóxido de nitrógeno es un gas incoloro. Está extendido por el aire producido por los automóviles y por las plantas energéticas. Es una molecula muy poco estable en el aire, puesto que se oxida rápidamente convirtiendose en dióxido de nitrógeno. Se utiliza para encontrar radicales libres (que son moleculas extremadamente inestables, con gran poder reactivo) en la superficie de polímeros (que son macromoleculas orgánicas).
7. El pH es una medida de la basicidad o la acidez de una sustancia. El pH depende de la concentración de los iones de hidrógeno que contiene dicha sustancia. Debimos medir su Ph al recogerlo pues al principio era una sustancia muy ácida y tuvimos que convertirla en una sustancia menos ácida para que así cuando la fuesemos a verter a la botella de residuos y se llevase al lugar donde se vierta, no contamine mucho la tierra al ser tan ácida.
8. No está bien hecho, aunque los productos de la tercera reacción son menos contaminantes, puesto que no contiene ningun metal pesado. Hubiese sido mejor recoger todas las reacciones en un bote de residuos, pero hemos recogido la más contaminante que era la tercera debido a su grado de acidez.
9. Hemos calentado la tercera reacción puesto que era más lenta que las otras dos ya que sus puntos de ebullición y ebullición son muy altos: del cloruro amónico, su punto de ebullición está en los 540 ºC y su punto de sublimación está en 340 ºC y el punto de fusión de la sosa está en los 318 ºC por lo que se necesitaba calentarlo ya que si no es muy dificil y se tarda mucho en esperar a que reaccionen.
RESULTADOS DEL TRABAJO:
OBTENCIÓN DEL GAS HIDRÓGENO:
Cuando añadimos el Zn al HCl vemos que en la reacción salen burbujas del Zn que se está consumiendo y sale un gas que podemos ver y que huele como a bomba fétida lo que nos puede sugerir que éstas se hagan con reacciones de este tipo. Vemos que si tocamos la base del tubo de ensayo ésta está caliente lo que nos indica que es una reacción exotérmica en la que se produce calor. Una vez puesto el globo vemos que éste se hincha y por la reacción sabemos que es gas hidrógeno. Lo que huele mal no es el gas H pues nos hemos informado y hemos visto que éste es inoloro así que el olor vendrá de la reacción que produce el HCl. Teóricamente si soltamos el globo éste debería subir lo que ocurre es que como hay muy poco H y el globo pesa bastante pues no conseguimos que ascienda. Subiría pues el H es menos denso que el airel. Una cosa curiosa que observamos es que si le prendemos fuego al globo éste estalla. Esto nos puede indicar que así se consigan las bombas de H tan famosas aunque no creo pues tiene algo que ver a nivel nuclear.
OBTENCIÓN DE DIÓXIDO DE NITRÓGENO:
Cuando añadimos a una pieza de cobre, HNO3 lo primero que observamos es que el Cu empieza a burbujear pues está reaccionando y el líquido que resulta de la reacción se torna verde y
 empieza a surgir un humillo amarillo/anaranjado que sería el NO. Esto fue lo que pensamos en un principio pero hemos descubierto que el NO es incoloro y por tanto el gas amarillo o es NO2 o es un gas que surge de la reacción. Vemos que nada más salir el gas del tubo de ensayo, éste tiende a irse contra la mesa pues es más denso que el aire y portanto baja hacia abajo. Vemos que el tubo también está caliente luego será una pequeña reacción exotérmica. Hemos escuchado que suena al reaccionar y el olor es el del cloro de la piscina. Si lo medimos con un medidor de Ph vemos que se torna completamente rojo lo (esto es gas nitrogeno que se vierte a la atmósfera, NO2) que nos indica que es una sustancia muy ácida. Si le echamos agua observamos que el papelito se tiñe rojo pero menos pues el agua lo que hace no es bajar el Ph sino aumentar la disolución y que ésta esté menos concentrada lo que concuerda con que sea menos rojo pues las moleculas de sustancia ácida que caerán serán menores. Al hacer esto hemos "reducido su acidez" y por tanto lo podremos echar en el recipiente de residuos. La sustancia se vuelve azul. (en este video se puede ver el proceso explicado)
empieza a surgir un humillo amarillo/anaranjado que sería el NO. Esto fue lo que pensamos en un principio pero hemos descubierto que el NO es incoloro y por tanto el gas amarillo o es NO2 o es un gas que surge de la reacción. Vemos que nada más salir el gas del tubo de ensayo, éste tiende a irse contra la mesa pues es más denso que el aire y portanto baja hacia abajo. Vemos que el tubo también está caliente luego será una pequeña reacción exotérmica. Hemos escuchado que suena al reaccionar y el olor es el del cloro de la piscina. Si lo medimos con un medidor de Ph vemos que se torna completamente rojo lo (esto es gas nitrogeno que se vierte a la atmósfera, NO2) que nos indica que es una sustancia muy ácida. Si le echamos agua observamos que el papelito se tiñe rojo pero menos pues el agua lo que hace no es bajar el Ph sino aumentar la disolución y que ésta esté menos concentrada lo que concuerda con que sea menos rojo pues las moleculas de sustancia ácida que caerán serán menores. Al hacer esto hemos "reducido su acidez" y por tanto lo podremos echar en el recipiente de residuos. La sustancia se vuelve azul. (en este video se puede ver el proceso explicado) OBTENCIÓN DE AMONIACO:

Cuando añadimos sosa disuelta en agua a el NH4Cl (cloruro amónico) vemos que la sosa se empieza a disolverse por completo pues con el agua estaba medio disuelta pero añadimos una fuente de calor con el mechero bunsen para acelerar la disolución y la reacción. Vemos que hay particulas que suben que probablemente sea un gas y que al olerlo pica la nariz. Huele a amoniaco que es uno de los productos de la reacción. El cloruro amónico se disuelve y luego hay algo que se evapora pues aparece un gas.
6.CONCLUSIONES: Al principio nos planteamos como objetivos el desarrollar habilidades básicas en el laboratorio de química y física (por ejemplo descubrir que no se un juego y que puede sin control resultar peligroso, normas de seguridad, uso del material y tratamiento correcto de las sustancias). También nos planteamos usar de forma práctica nuestros conocimientos de química inorgánica aplicada y por último el concepto de reacción química. Hemos introducido el ajuste de reacciones químicas mediante métodos estequiométricos. Hemos visto lo que era un producto y un reactivo y el concepto de disolución. Los objetivos han sido cumplidos. La diferencia básica entre disolución y reacción es que en una disolución las sustancias utilizadas al mezclarlas siguen siendo las mismas mientras que en una reacción aparecen sustancias nuevas. En este trabajo hemos obtenido gases a partir de distintas reacciones químicas y hemos observado lo que ocurría y sacado conclusiones. Nuestra conclusión ha sido parecida a la que teníamos anteriormente pues sabíamos que iban a ocurrir cosas muy curiosas. Hemos descubierto que a partir de un ácido y un metal se pueden conseguir gases como el H que al prenderlos estallen y que durante el proceso químico de obtención ocurran cosas interesantes como el olor producido. También hemos observado que se puede conseguir gases como el NO, en el cual observamos que el agua se teñía y que surgía un gas amarillo misterioso que no es el N (hemos visto en internet que el NO es incoloro). Finalmente hemos visto una manera de obtener NH3 y observado que si lo olemos pica mucho la nariz.
7.BIBLIOGRAFÍA:
Hemos utilizado el google y la wikipedia y las notas tomadas en nuestro cuaderno así como la información contenida en éste.
8.AGRADECIMIENTOS:
Debemos agradecerselo a Ángel pues el nos ha ayudado a utilizar las sustancias peligrosas que nosotros no conocíamos y que sin su ayuda podría habernos causado daño. También nos a explicado como utilizarlas.






2 comentarios:
angel de parte del grupo seguimos teniendo problemas al colocar la fuente de la letra. esta vez en el doc pusimos todos el mismo formato al trabajo y al pasarlo y poner imagenes se no separo todo el texto y se nos cambio el formato sin posibildad de cambiarlo igual. Perdonanos por esto e intentaremos al siguiente que no ocurra.
Jorge,Dani,Juan
Cuando uno coloca una imagen debe explicarla. Si es una imagen de presentación, se suele poner sólo una.
El resumen es demasiado extenso, habéis desvelado casi todas las sorpresas del trabajo...
En la introducción se repiten algunas de los comentarios del resumen.
La descripción de las reacciones es muy completa, cuando escribís métodos, se escribe método.
Cuestiones:
1- La primera y tercera reacciones están bien ajustadas. La segunda no tiene oxígeno, hay que interpretar qué le ocurre al NO.
2- ok
3- ok
4- bien, se escribe fondo del tubo (aunque coloquialmente se diga culo). Buen razonamiento.
5- se escribe explosión. Me parece muy apropiado el comentario del vídeo. Bastante bien investigado.
6- bien.
7- sabéis qué es un logaritmo?? bien
8- ok
9-ok
Los resultados deberían colocarse detrás del método experimental seguido. Hay mucha repetición y eso hace que acabe siendo una entrada demasiado larga y repetitiva. Conceptualmente es bastante buena. Me encanta la caricatura!!!
Buen trabajo
Publicar un comentario